分子极性和分子间作用力
一、分子的极性
分子的极性取决于该分子正、负电荷中心的相对位置;非极性分子正、负电荷中心重合,极性分子两者不重合。分子的极性通常用电偶极矩表示。极性分子的电偶极矩(μ)等于正电荷或负电荷中心的电荷值(q)乘以正负电荷中心之间的距离(d),μ的单位为Debye(缩写为D),1D=3.336×10-30C•m(库仑·米)。极性分子的μ值一般在1~3D(表1-2)。
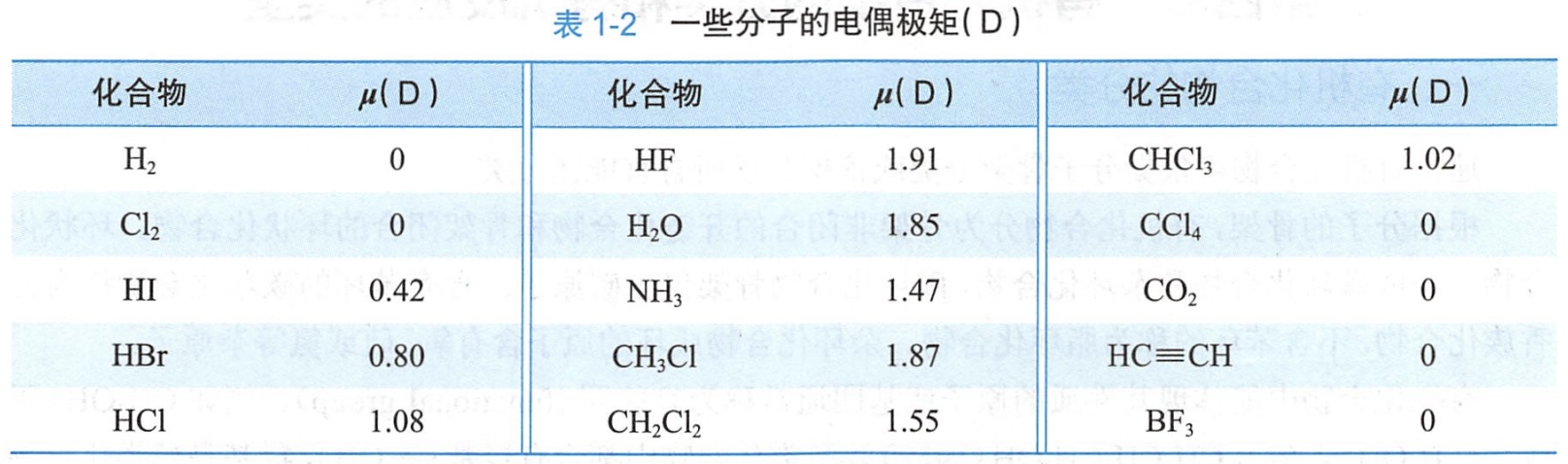
双原子分子的分子键的极性就是分子的极性。含两个以上原子的分子的极性与各个键的极性以及键的方向和分子的形状相关。
有些分子具有极性键,却是非极性分子。例如,二氧化碳有两个极性的C=O键,由于它是线性对称的分子,键的极性相互抵消,所以二氧化碳为非极性分子;四氯化碳的碳氯键是极性键,由于四氯化碳是对称的正四面体结构,键的极性相互抵消,分子也是非极性的;而在一氯甲烷中,碳氯键的极性决定了其分子的极性。
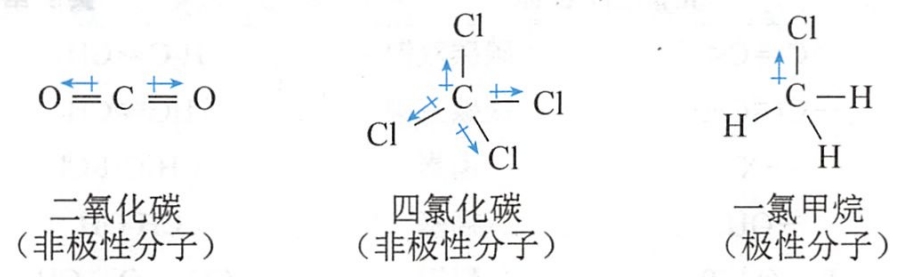
符号表示键的偶极,箭头的指向是从部分正电荷到部分负电荷的方向。
分子的极性越大,分子间相互作用力就越大。化合物分子的极性直接影响其沸点、熔点及溶解度等物理性质和化学性质。
二、分子间的作用力
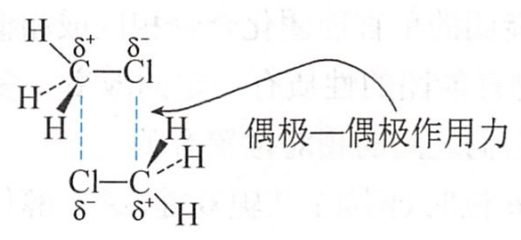
一个分子的偶极正端与另一分子的偶极负端之间的吸引力称为偶极-偶极作用力(dipole-dipole interaction)。例如:一氯甲烷分子中氯带部分负电荷(δ-),碳带部分正电荷(δ+),一氯甲烷分子间可通过偶极-偶极作用力相互吸引。
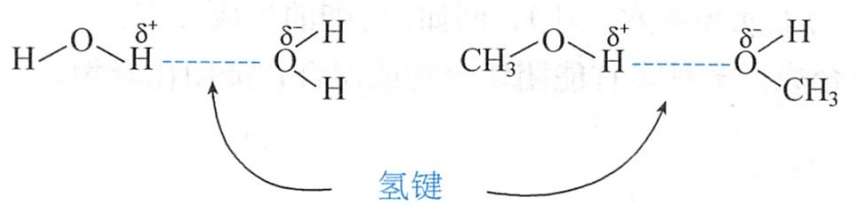
氢键(hydrogen bond)存在于以共价键与其他原子键合的氢原子与另一个原子之间(Z-H···Y),通常发生氢键作用的氢原子两边的原子(Z、Y)是O、N等电负性较强的原子。氢键键能一般为5~30kJ/mol。
氢键在自然界中广泛存在,既存在于分子间,也存在于分子内。氢键对于稳定核酸和蛋白质的二、三和四级结构起着重要作用。
静态时,非极性分子偶极矩为零;运动过程中非极性分子产生瞬时偶极。瞬时偶极能导致非极性分子间的相互作用,尽管该作用力很弱,但它的作用广泛。瞬时偶极是维系细胞膜的磷脂非极性链之间的重要作用力。